Vom Tumor zur Therapie
Wenn es um Krankheiten geht, ist die optimale Behandlung häufig so individuell wie der Patient selbst. Das gilt auch für den jeweiligen Tumor. Dennoch basieren viele Krebstherapien heute auf statistischen Durchschnittswerten. Im Projekt „photiomics“ von Bosch Research entwickelte Bernd Scheufele mit seinem Team einen Tumor-Bioreaktor, der personalisierte Medikamententests mit echtem Tumorgewebe ermöglicht – außerhalb des Körpers, automatisiert und standardisiert.

Wenn ein Mensch die Diagnose Krebs erhält, beginnt ein Wettlauf gegen die Zeit. Welche Therapie wirkt? Was hilft individuell – nicht nur statistisch? Diese Fragen standen am Anfang des Projekts „Cells-on-Chip“-Technologie für personalisierte Krebsbehandlung von Bosch Research, das 2018 als Ein-Mann-Initiative begann und heute in Form eines funktionalen Tumor-Bioreaktors erste Antworten liefert. „Ich komme aus der klinischen Forschung“, sagt Dr. Bernd Scheufele, interdisziplinär forschender Physiker bei Bosch Research. „Mir lagen schon immer Projekte am Herzen, die Patientinnen und Patienten, ihren Familien und den Menschen drum herum direkt helfen“, ergänzt er. Schon in seiner Arbeit im Tübinger Universitätsklinikum beschäftigte ihn die Frage, weshalb in der Krebstherapie stets ein Standard vorgegeben wird und nicht die Besonderheiten der Patienten zuvorderst betrachtet werden. „Jeder Mensch hat einzigartige genetische und gewebespezifische Eigenschaften und jeder Tumor ist unterschiedlich.“
Das interdisziplinäre Projekt photiomics
Heute beruht Krebstherapie in der Regel auf klinischen Leitlinien, also evidenzbasierten und statistisch ermittelten Durchschnittswerten. Doch Krebs ist individuell. Tumore unterscheiden sich genetisch, immunologisch und in ihrer Mikrostruktur. Dieser personalisierte Ansatz bahnte den Weg zu dem vom Bundesministerium für Forschung, Technologie und Raumfahrt (BMFTR) geförderten Verbundprojekt photiomics (Förderkennzeichen 13N15768). Der Projektname photiomics ist ein Kunstbegriff angelehnt an die Kombination der Begriffe Photonics und Genomics. Von 2022 an arbeiteten Bernd Scheufele und sein Team rund drei Jahre gemeinsam mit Partnerinnen und Partnern aus Klinik, Forschung und Industrie (Dr. Margarete Fischer-Bosch Institut für Klinische Pharmakologie am Bosch Health Campus, Zellkraftwerk GmbH/Canopy Biosciences/Bruker Group, Raylytic Software GmbH). Das Ziel war es, Erfolgschancen einer Arzneimitteltherapie zu steigern, indem Medikamente bereits vor Beginn der Therapie individualisiert ausgewählt werden.
Aufbauend auf der bei Bosch schon etablierten Lab-on-Chip-Technologie arbeitete das Team um Bernd Scheufele an einer neuen Herangehensweise für personalisierte Krebstherapie: ein lebendiger Tumorschnitt, der in einem kompakten technischen System automatisiert mit Medikamenten getestet wird. Dieses System ist ein sogenannter Tumor-Bioreaktor, der es ermöglicht, direkt am konkreten Tumorgewebe eines Menschen zu prüfen, welche Substanz anschlägt und welche nicht. So könnten belastende und unwirksame Therapien vermieden und effektivere Wege früher gefunden werden. „Wir nutzen Gewebe, das ohnehin bei der Diagnose oder Operation entnommen wird. Statt es nur histologisch zu analysieren, testen wir direkt, wie es auf verschiedene Medikamente reagiert“, sagt Bernd Scheufele.
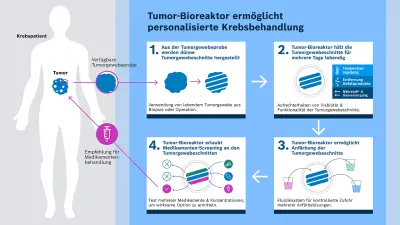
Die Funktionsweise des Tumor-Bioreaktors
Die Frage, die alles ins Rollen brachte, klingt simpel – ist aber medizinisch hochkomplex: Wie lässt sich vorhersagen, welches Medikament bei einem konkreten Tumor tatsächlich wirkt – und welches nicht?
Komplexe Probleme lassen sich am besten mit interdisziplinären Teams lösen. So auch bei photiomics. Bernd Scheufele arbeitete bei Bosch Research mit Forscherinnen und Forschern aus den Domänen Physik, Biologie, Chemie, Fluidik, Optik und Systemtechnik zusammen. Das Ziel war, einen funktionalen Tumor-Bioreaktor zu entwickeln, der diese Dinge leisten kann: lebensfähige Tumorschnitte über mehrere Tage zu kultivieren, automatisierte Fluoreszenzfärbung und Medikamentenbehandlung von lebenden Tumorschnitten.
Im Tumor-Bioreaktor laufen folgende drei Kernprozesse ab: Erhalten der Lebendigkeit des Gewebes, farbcodierte Reaktionen, um unterschiedliche Wirkungen von Medikamenten zu identifizieren, und automatisierte Medikamentengabe. Anders als bei herkömmlichen Methoden wird das Tumorgewebe direkt nach der Entnahme verarbeitet, anstatt es zu fixieren oder einzufrieren. Durch schonendes Schneiden mit einem vibrierenden Messer entstehen lebendige Gewebeschnitte mit einer Dicke von circa 150 bis 300 Mikrometern, die in ihrer natürlichen Zellstruktur bleiben. Das Tumorgewebe sollte dafür mindestens fünf Millimeter groß sein. Dem Bosch Research-Team gelang es, die Tumorschnitte im Tumor-Bioreaktor über mehrere Tage lebensfähig zu halten. Damit sind zahlreiche Medikamententests möglich. Die Kultivierung der Tumorschnitte erfolgt durch eine präzise Flüssigkeitsversorgung mit Nährstoffen, Gasaustausch, Abtransport von Abfallstoffen und Temperatursteuerung.
Die Gewebeschnitte sind Querschnitte des Tumorgewebes mit seinen verschiedenen Schichten und Strukturen. In den Gewebeschnitten markieren fluoreszierende Färbungen Zelleigenschaften, sodass sich auch subtile Reaktionen auf Medikamente erkennen lassen. Bis zu neun Schnitte können aktuell parallel getestet werden – mit unterschiedlichen Substanzen oder Dosierungen. Die Effekte werden entweder direkt im Gewebe oder durch Analyse der Flüssigkeit über dem Schnitt sichtbar. Durch fluoreszierende Marker können unterschiedliche Zelltypen, Biomarker oder Reaktionen sichtbar gemacht werden.
Für diese Prozesse entwickelten die Forscherinnen und Forscher des Konsortiums die benötigte Infrastruktur. Das fluidische System des Tumor-Bioreaktors, entwickelt durch Bosch Research, ermöglicht nun das präzise Dosieren verschiedener Medikamente – mit definierten Konzentrationen und Volumina – auf die Tumorschnitte. In Kooperation mit den Partnern werden mithilfe eines Mikroskops die Reaktionen erfasst und die Bildgebung sowie Analyse beginnen.

Die Perspektive personalisierter Therapie
Derzeit setzen Bernd Scheufele und sein Team den Tumor-Bioreaktor in umfangreichen Tests ein. Langfristig könnte er ein entscheidendes Diagnoseinstrument für die personalisierte Krebstherapie werden – in Ergänzung zu herkömmlichen Tumorboards. Außerdem ist er auch für präklinische Medikamententests und in der Pharmaforschung zur Entwicklung neuer Wirkstoffe nutzbar. Die Vorteile liegen auf der Hand: weniger ineffektive Therapien, geringere Nebenwirkungen, höhere Erfolgswahrscheinlichkeit.
Für Bosch eröffnet sich mit dieser Technologie ein neues Feld bei medizinischen Diagnostiksystemen, insbesondere im Zukunftsmarkt der funktionalen Arzneimitteltests mit Lebendgewebe. Noch ist der Bioreaktor nicht klinisch zugelassen. Für den medizinischen Routineeinsatz braucht es klinische Studien, die nachweisen, dass die Vorhersagekraft des Systems tatsächlich zu besseren Therapieentscheidungen führt. Es muss dazu noch medizinische und klinische Forschung durchgeführt werden, die zeitintensiv und unerlässlich ist, so Bernd Scheufele.
Auch technologisch hat das Bosch Research-Team schon Weiterentwicklungen im Visier: Skalierung auf mehr Tumorschnitte – rund 50 Schnitte pro Gewebeprobe könnten möglich sein –, verbesserte Bildanalyse mithilfe künstlicher Intelligenz und die Testung neuartiger Wirkstoffkombinationen. Zudem könnte die Plattform auch für präklinische Studien in der Pharmaindustrie eingesetzt werden, etwa zur Identifikation von Resistenzen, Nebenwirkungen oder Kombi-Effekten, also die Wechselwirkung von gleichzeitig verabreichten Medikamenten. Mit dem erfolgreichen Projektabschluss im Oktober 2025 hat sich einer von Bernd Scheufeles Herzenswünschen schon erfüllt: „Wir haben gezeigt, dass es geht. Jetzt wollen wir zeigen, was es bewirkt.“
Profil

Bernd Scheufele
Bernd Scheufele leitet die „Cells-on-Chip“-Technologie für personalisierte Krebstherapien bei Bosch Research. Er hat Physik an der Universität Tübingen studiert, an der Technischen Universität Kaiserslautern promoviert und verfügt über umfangreiche Erfahrungen in Medizintechnikentwicklung, Mikrofluidik und klinischen Wissenschaften. Vor seiner Tätigkeit bei Bosch forschte er zur Blutzirkulation und entwickelte piezoelektrische Mikropumpen und Lab-on-Chip-Systeme. Bei Bosch schuf er einen 3D-Ultraschallsensor für automatisiertes Fahren und leitet heute die „Cells-on-Chip“- und Photiomics-Projekte im strategischen Portfolio Healthcare Solutions.